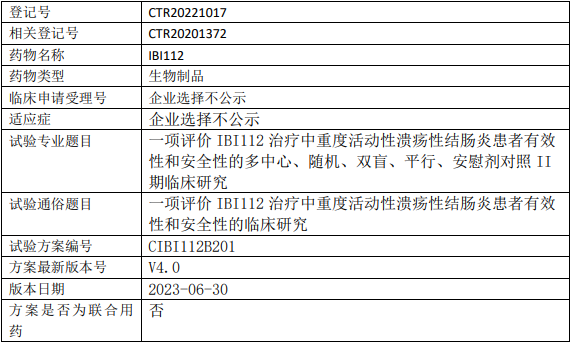
信达生物IBI112临床试验,评价IBI112治疗中重度活动性溃疡性结肠炎有效性和安全性的II期临床试验
试验目的
主要目的
评价IBI112诱导治疗中重度活动性溃疡性结肠炎患者(Ulcerative Colitis,UC)达到临床缓解的有效性。
次要目的
1、评价IBI112诱导治疗中重度活动性溃疡性结肠炎患者达到临床应答、症状缓解、内镜缓解、黏膜愈合的有效性;
2、评价IBI112维持治疗中重度活动性溃疡性结肠炎患者达到临床缓解、临床应答、症状缓解、内镜缓解、黏膜愈合的有效性;
3、评价IBI112诱导治疗和维持治疗中重度活动性溃疡性结肠炎患者的安全性;
4、评价IBI112诱导治疗和维持治疗对中重度活动性溃疡性结肠炎患者健康相关生活质量的影响;
5、评价IBI112在中重度活动性溃疡性结肠炎患者的药代动力学特征;
6、评价IBI112在中重度活动性溃疡性结肠炎患者的免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、18岁≤年龄≤75岁的男性或女性;
2、诊断为溃疡性结肠炎至少3个月,包括支持UC的内镜检查证据和支持UC诊断的组织病理学证据;
3、患有中重度溃疡性结肠炎,定义为改良Mayo评分≥4分且内镜评分≥2分;
4、对方案中规定的治疗应答不足或不耐受;
5、筛选实验室结果在方案中规定的参数范围内。
排除标准
1、诊断为缺血性结肠炎、感染性结肠炎、放射性结肠炎、显微镜下结肠炎、不确定结肠炎等或提示克罗恩病; 2、UC病变范围局限于直肠或累及结肠<15cm;
3、筛选时发现中毒性巨结肠的证据;
4、有结肠非典型增生、腺瘤息肉(进入研究前未切除)或胃肠道肿瘤病史或证据;
5、既往因溃疡性结肠炎接受过广泛结肠切除术、次全切除或全结肠切除术、回肠造口术、结肠造口术;
6、因溃疡性结肠炎需要手术或计划在研究期间进行择期手术的受试者;
7、筛选前2个月内,对活动性胃肠道出血、腹膜炎、肠梗阻、肠道狭窄、腹腔脓肿或胰腺脓肿进行过手术,或筛选前2周有上述状况需要进行手术;
8、有证据表明受试者患有严重的、进行性的或不可控制的心血管疾病、血液疾病、内分泌疾病、肾脏疾病、肝脏疾病、呼吸疾病、神经或精神疾病;
9、筛选前6个月内患过严重的机会感染如:严重或复发型带状疱疹、活动性巨细胞病毒感染、卡氏肺囊虫、组织胞浆菌、曲霉菌、分歧杆菌等感染;
10、筛选期内或首次给药前4个月艰难梭菌检测呈阳性,重复检测结果为阴性且没有该病原菌持续感染症状的除外(若时间允许,可在筛选期间进行治疗和重复检测)。