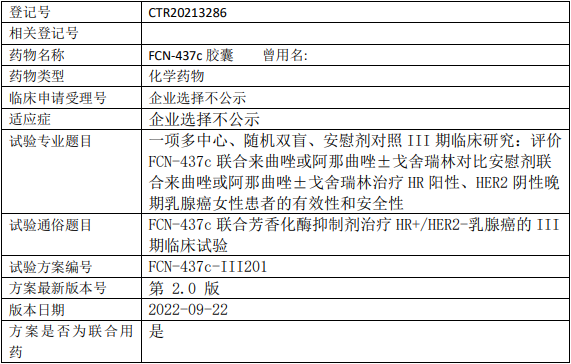
复创医药/复尚慧创FCN437c临床试验,评价FCN-437c胶囊联合来曲唑或阿那曲唑±戈舍瑞林对比安慰剂联合来曲唑或阿那曲唑±戈舍瑞林治疗HR阳性、HER2阴性女性晚期乳腺癌的III期临床试验
试验目的
主要目的
评估FCN-437c联合来曲唑或阿那曲唑在HR+、HER2-晚期乳腺癌患者中的疗效是否优于安慰剂联合来曲唑或阿那曲唑治疗。
次要目的
评估FCN-437c联合来曲唑或阿那曲唑治疗对比安慰剂联合来曲唑或阿那曲唑治疗的安全性。
探索性目的
评估和比较患者生存质量变化。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:女
健康受试者:无
出入排标准
入选标准
1、年龄≥18岁的绝经后或绝经前/围绝经期女性患者;
2、绝经后定义为:
●双侧卵巢切除术后;
●年龄≥60岁;
●年龄<60岁,且在没有化疗和服用他莫昔芬、托瑞米芬和卵巢功能抑制治疗的情况下停经1年以上,同时血FSH及雌二醇水平符合绝经后的范围;
●而正在服用他莫昔芬、托瑞米芬,年龄<60岁的停经患者,必须连续检测血FSH及雌二醇水平符合绝经后的范围;
3、确诊为HR+、HER2-的晚期乳腺癌女性患者;
4、不适合以治愈为目的的手术切除或放射治疗,且无进行化疗的临床指征;
5、未接受过任何针对局灶性复发或转移性疾病的系统性抗癌治疗(在随机前因晚期乳腺癌接受内分泌治疗≤28天的患者允许入组,因晚期乳腺癌接受系统性化疗不超过 1 个周期且未进展的患者允许入组),辅助内分泌治疗完成后无疾病生存时间超过12个月的患者允许入组;
6、美国东部肿瘤合作组(Eastern cooperative oncology group,ECOG)体力状况评分0或1分;
7、根据RECIST 1.1标准,患者必须至少有一个可测量的病灶,或仅有骨转移的患者,如果不存在可测量的病灶,则必须至少存在一个以溶骨性病变为主的骨病灶;
8、预计生存期至少12周;
9、患者有足够的骨髓和器官功能;
10、QTcF<470ms;
11、对于有生育能力的患者:患者应同意在治疗期间及研究治疗末次给药后至少90天内禁欲或使用高效的避孕方法,如宫内节育器,宫内节育系统,两侧输卵管阻塞,伴侣输精管结扎;不能采用激素类避孕药避孕。
12、患者充分了解本研究,并已签署知情同意书(Inform consent form,ICF),愿意并有能力遵从计划的访视、治疗计划、实验室检查及其他试验程序。
排除标准
1、既往接受过CDK4/6抑制剂治疗;
2、既往接受过内分泌药物新辅助治疗或辅助治疗过程中或结束后12个月内疾病进展或复发;
3、随机前4周内接受过系统性抗肿瘤治疗;
4、存在有重要脏器转移或大肿瘤负荷不适合内分泌治疗的患者;
5、临床疑似脑转移、脑膜转移或不稳定脑实质转移者,但稳定的脑转移可入组;
6、炎性乳腺癌;
7、存在临床上未控制的、需要反复引流或医疗干预(在随机前2周内)的胸腔积液、心包积液或腹水;
8、参加研究前3年内曾诊断为任何其他恶性肿瘤,经根治性治疗的早期恶性肿瘤(原位癌或Ⅰ期肿瘤);
9、既往抗肿瘤治疗的毒性反应尚未恢复(≥NCI-CTCAE 5.0 版规定的2级),但脱发除外;
10、进入研究前的6个月内,出现以下情况:心肌梗死、严重/不稳定型心绞痛、NYHA 2级以上心功能不全、≥2级的持续心律失常(根据NCI CTCAE 5.0版)、任何级别的房颤、冠状/周边动脉搭桥术、症状性充血性心力衰竭、脑血管意外(包括一过性脑缺血发作),或症状性肺栓塞;
11、吞咽困难,或患有活动性消化系统疾病,或接受过重大消化道手术,或患有吸收不良综合症,或其他可能损害FCN-437c吸收的情况;
12、已知对试验用药来曲唑,阿那曲唑,戈舍瑞林,或对FCN-437c或其他任何辅料过敏;
13、活动性感染;
14、已知异体器官移植史或异体造血干细胞移植史;
15、怀孕或哺乳期女性;
16、研究者认为可影响方案依从性或影响患者签署ICF的具有临床意义的任何其他疾病或状况;