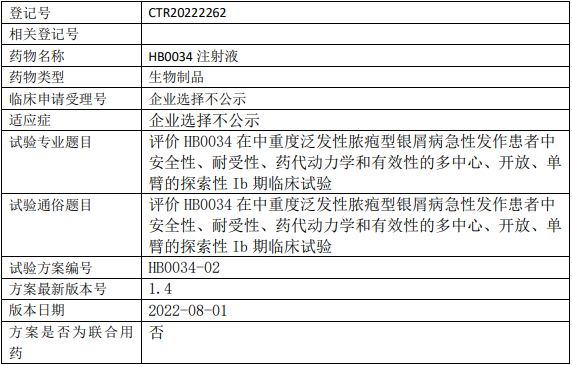
华奥泰/华博生物HB0034临床试验,评价HB0034注射液治疗中重度泛发性脓疱型银屑病急性发作的Ib期临床试验
试验目的
主要目的
评价单次静脉给与HB0034在泛发性脓疱型银屑病患者中的安全性和耐受性。
次要目的
初步评价HB0034治疗GPP急性发作的疗效、为后续临床研究开展提供依据;
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄介于18岁至75岁(包括18岁和75岁)的男性或女性患者
2、体质指数(BMI)介于17.5至32kg/m2(包括17.5和32kg/m2)
3、基线时中重度泛发性脓疱型银屑病急性发作,同时满足以下3条标准:
(1)泛发脓疱型银屑病医生整体评价(GPPGA)≥3;
(2)新发脓疱或现有脓疱恶化,GPPGA脓疱亚项评分≥2;
(3)红斑伴脓疱受累体表面积(BSA)≥10%
4、育龄男性和女性:无生育计划,并且愿意在本研究期间及研究给药后90天内采取可靠的避孕措施
5、能充分理解并自愿签署知情同意书(ICF),愿意且能够遵守临床研究和后续访视流程
排除标准
1、药物诱发的急性泛发性发疹性脓疱病(AGEP)
2、SAPHO(滑膜炎-痤疮-脓疱病-骨肥厚-骨炎)综合症的患者
3、患有原发性斑块型寻常型银屑病,不存在脓疱或脓疱仅限于银屑病斑块的患者
4、根据研究者的判断,出现立即危及生命的发作或需要重症监护治疗。危及生命的并发症,主要包括但不限于心血管/细胞因子驱动的休克、呼吸窘迫综合征或肾衰竭
5、根据研究者的判断,存在重度、进展性或未控制的肾脏、肝脏、血液学、内分泌、肺、心脏、神经系统、脑或精神疾病,或其体征和症状(包括控制不佳的高血压、控制不佳的糖尿病,不稳定的心绞痛、充血性心力衰竭等疾病);AST或ALT或碱性磷酸酶>3倍正常值上限(ULN),或总胆红素>2倍ULN
6、根据研究者的评估,感染并发症的风险增高(例如最近的化脓性感染、任何先天性或获得性免疫缺陷(例如HIV、既往器官或干细胞移植)
7、研究给药前6周内曾接受过活疫苗接种或试验用活疫苗,或在研究期间或完成本研究给药后6周内计划接受活疫苗接种或参与试验用活疫苗临床研究
8、研究给药前1个月内出现严重外伤或经历重大手术、或在研究期间计划进行任何择期手术
9、有记录证实的活动性或疑似恶性肿瘤或筛选前5年内有恶性肿瘤史
10、有严重过敏史,接受其它单克隆抗体治疗时发生过3-4级过敏反应,或已知对蛋白质药物或重组蛋白、HB0034药物组分过敏者
11、怀孕或者哺乳期的受试者;接受研究给药前3天内血清妊娠试验(HCG)阳性
12、目前入选另一项试验器械/药物研究或者距离另一项试验器械/药物研究结束后不到30天,或者接受另一种试验用药品治疗
13、预计依从性差,例如不配合、不能按时随访及不太可能完成研究的受试者
14、其他原因研究者认为不合适参加本研究