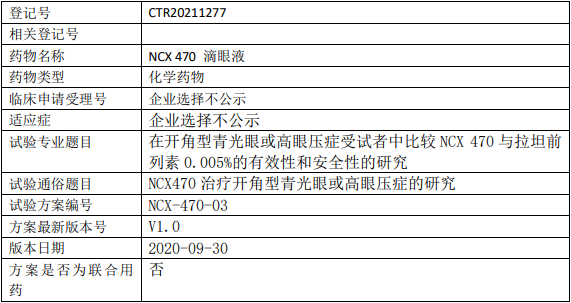
欧康维视NCX470临床试验,NCX470滴眼液治疗开角型青光眼或高眼压症的III期临床试验
试验目的
本研究的主要目的是证明NCX470滴眼液(0.1%)QD不劣于拉坦前列素滴眼液(0.005%)QD
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至84岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.满18周岁(含)并低于85周岁(不含)的受试者。在启动任一研究相关程序前,按照人用药品注册技术要求国际协调会(ICH)《药物临床试验质量管理规范》(GCP)指导原则和当地法规,签署知情同意书(ICF)之日,受试者应达到法定年龄(至少18周岁)且必须能够提供参与研究的书面知情同意。
2.受试者的双眼均被诊断为开角型青光眼(OAG)或高眼压症(OHT)(对于OHT,在筛选时必须具有至少6个月内的诊断记录),患剥脱性青光眼或色素性青光眼的受试者可以入组。
3.如果接受开角型青光眼(OAG)或高眼压症(OHT)的治疗,则在筛选访视前双眼的治疗和给药方案必须已稳定30天。
4.受试者必须在符合第1次入选资格访视(第-3天至第-7天)和第2次入选资格访视(第1天)时的以下对眼内压(IOP)的要求:研究眼的IOP在8AM≥26mmHg,10AM≥24mmHg,且4PM≥22mmHg,在全部3个测量时间点,双眼IOP≤36mmHg;且左右眼的日间IOP均值差异≤4mmHg。
5.筛选访视时接受PGA或NO供体PGA治疗的受试者,经过第1次和第2次入选资格访视的洗脱期后,研究眼自时间匹配的IOP增加必须≥4mmHg。
6.受试者使用糖尿病视网膜病变早期治疗研究(ETDRS)视力表评估每眼最佳矫正视力(BCVA)为+0.7logMAR单位(Snellen等效值~20/100)或更佳。
7.若受试者为女性,必须因双侧卵巢切除术、子宫切除术、双侧输卵管结扎术或处于绝经后(已闭经至少2年)而无法怀孕,或必须在研究期间使用有效(如双重屏障)避孕方法。具有生育能力的女性受试者必须进行妊娠试验且结果为阴性,且未处于哺乳期。
8.能够且愿意遵守所有研究程序的受试者。
排除标准
1.晚期青光眼或任一只眼杯盘比大于0.8、或有注视点分裂、或危及注视点的视野缺损或重度视野缺损的受试者。无法可靠执行视野检查的受试者(可靠性标准见附录2)。
2.不愿意或无法终止当前使用的降IOP药物的受试者。(允许在筛选访视和第1次入选资格访视之间使用洗脱期更短的降IOP药物)。
3.房角狭窄的受试者(根据Shaffer前房角分级系统,3个象限低于2级)和任一只眼存在房角关闭、临床显著性周边前粘连、先天性青光眼或有房角关闭病史的受试者。
4.任一眼中央角膜厚度小于480μm或大于620μm的受试者。
5.存在导致任一眼无法接受压平眼压测定法的任何情况的受试者(例如角膜表面明显异常、角膜瘢痕、圆锥角膜)。
6.在第1次入选资格访视或第2次入选资格访视的8AM评估时,任一眼患有>1级结膜充血(分级为0-无至3-严重)的受试者。
7.根据研究者的判断,任一眼既往或目前患有具有临床意义的活动性角膜疾病从而可能影响研究结果的受试者。
8.任一只眼的中央角膜内皮细胞密度<2000个细胞/mm2的受试者。(注:此标准仅适用于将在美国随机化分配的前200例受试者和将在中国随机化分配的前50例受试者的初始亚组,将收集这些受试者的12个月安全性数据。)
9.任一眼有严重干眼史的受试者。
10.任一眼有任何活动性或复发性眼内感染、炎症、虹膜炎或葡萄膜炎的受试者。
11.任一眼确诊为具有临床意义的视网膜疾病(例如糖尿病性视网膜病变、黄斑变性、视网膜中央静脉或动脉阻塞、黄斑水肿)的受试者。
12.不愿或不能在第2次入选资格访视、第3个月访视、第6个月访视和第12个月访视的前1周停止使用硬性隐形眼镜或前2天停止使用软性隐形眼镜的受试者。不愿或不能在研究访视日停止使用角膜接触镜的受试者。
13.任一只眼曾行青光眼或房角手术或操作[例如,YAG激光虹膜周边切开术、粘小管成形术、小梁切除术、氩激光小梁成形术(ALT)]的受试者。
14.任一眼植入或取出微创青光眼植入物(MIG)的受试者。
15.在筛选访视前12个月内,任一眼接受选择性激光小梁成形术(SLT)的受试者。
16.任一眼既往有复杂白内障手术史或既往屈光性角膜切开术史的受试者。允许既往无并发症的白内障摘除术、角膜缘松弛术、YAG囊切开术、无并发症的LASIK(准分子激光原位角膜磨镶术)、PRK(准分子激光屈光性角膜切削术)和ASA(改良表面切削术),但前提是在筛选访视前6个月内未进行。
17.在筛选访视前6个月内,任一眼接受过眼部切口手术或发生过严重外伤的受试者,或预计在研究期间和研究用药末次给药后30天需要进行眼科手术的受试者。
18.对PGA类或对研究药物任何成分存在已知超敏反应或禁忌症的受试者。
19.对NO治疗存在已知禁忌症的受试者(例如重度低血压史、酒精滥用史)。
20.合并用药可能影响NO供体化合物的安全性或有效性者。
21.目前需要或预期研究期间需要眼部、局部或全身皮质类固醇治疗的受试者(允许使用吸入性、关节内或鼻内类固醇或皮肤外用类固醇[面部除外])。
22.预期在研究期间需要启用或换用已知会影响IOP的药物(全身或眼部)(例如β拮抗剂、α受体激动剂、钙通道阻滞剂、血管紧张素转换酶[ACE]抑制剂、血管紧张素Ⅱ受体阻滞剂)的受试者。
23.目前需要治疗或预期需要在研究期间接受任何眼部用药治疗的受试者,包括应用于眼睑或睫毛的药物(允许使用非处方药人工泪液和眼部抗组胺药)。
24.接受过前房内植入物(例如贝美前列素SR、曲伏前列素眼内植入物、地塞米松眼内植入剂)的受试者。
25.具有不受控制的全身性疾病史或存在全身性疾病,从而使研究者认为可能增加受试者风险或混淆研究结果的受试者。
26.在参与研究期间参与任何药物或器械临床研究的受试者,或在筛选访视前42天内接受过研究药物的受试者。
27.在II期NCX-470-17001临床试验或III期NCX-470-02试验中随机接受治疗的受试者。
研究者信息
主要研究者
姓名:孙兴怀
学位:医学博士
职称:主任医师、教授
单位名称:复旦大学附属眼耳鼻喉科医院
国内参加医院
医院名称:复旦大学附属眼耳鼻喉科医院
主要研究者:孙兴怀
医院地址:上海市徐汇区汾阳路83号