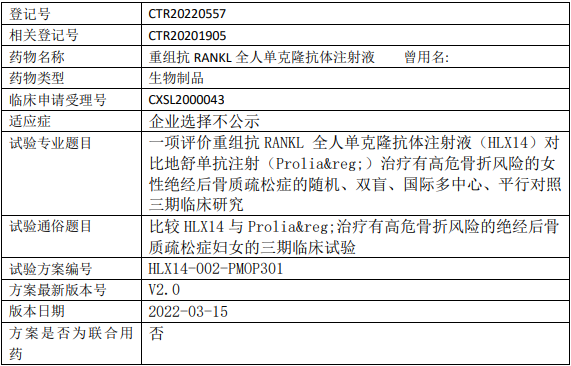
复宏汉霖HLX14临床试验,比较价重组抗RANKL全人单克隆抗体注射液(HLX14)和地舒单抗注射(Prolia)治疗有高危骨折风险的女性绝经后骨质疏松症的III期临床试验
试验目的
主要目的
评估HLX14和地舒单抗注射液(Prolia®)治疗有高危骨折风险的女性绝经后骨质疏松症的临床疗效是否等效。
次要目的
比较HLX14和地舒单抗注射液(Prolia®)治疗有高危骨折风险的女性绝经后骨质疏松症的安全性、药代/药效动力学和免疫原性。
试验设计
试验分类:生物等效性试验/生物利用度试验
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:50岁(最小年龄)至90岁(最大年龄)
性别:女
健康受试者:无
出入排标准
入选标准
1.受试者自愿签署知情同意书,理解本研究的性质、目的和试验程序并且在研究中愿意遵守研究的受试者。
2.能自由行走的绝经后骨质疏松女性,年龄50-90岁(含50岁和90岁)。
3.绝经后,定义为绝经时间>2年,即自发性闭经>2年或双侧卵巢切除术后>2年。如果双侧卵巢切除状态不明或年龄<60周岁已行子宫切除但卵巢保留者,可使用卵泡刺激素(FSH)水平>40U/L确认手术后绝经状态。
4.基于中心影像供应商双能X线吸收检测法(DXA)骨密度(BMD)测量结果,受试者腰椎或全髋部位BMDT值在-2.5到-4.0之间,即-4.0
排除标准
1.可影响骨代谢的疾病:各种代谢性骨病,例如骨软化症或成骨不全;佩吉特病(Paget骨病);库欣综合征;高催乳素血症;垂体功能减退症;肢端肥大症;多发性骨髓瘤;甲状旁腺功能亢进或甲状旁腺功能减退。
2.甲状腺疾病:甲状腺功能亢进或甲状腺功能减退,其中仅已接受稳定的甲状腺激素替代治疗的甲状腺功能减退症受试者可以根据以下标准入选:
1)如果TSH水平低于正常范围,则受试者不能参加研究。
2)如果TSH水平升高(>5.5μIU/mL但≤10.0μIU/mL),但血清T4在正常范围,受试者可以入选。如果血清T4超出正常范围,受试者不能参加研究。
3)如果TSH水平大于10.0μIU/mL,受试者不能参加研究。
3.类风湿性关节炎或强直性脊柱炎。
4.恶性肿瘤:签署知情同意书前5年内患有活动性恶性肿瘤(完全切除的原位皮肤基底细胞或鳞状细胞癌、宫颈癌或乳腺导管癌除外)。
5.吸收障碍综合征:吸收障碍综合征或与吸收障碍相关的各种胃肠道疾病,例如,克罗恩病和慢性胰腺炎。已知的钙吸收或维生素D吸收不良的受试者。
6.肾脏疾病导致严重的肾功能损伤,肾小球滤过率<30ml/min。
7.肝脏疾病:
1)肝硬化;
2)不稳定的肝病(定义为有腹水、肝性脑病、凝血障碍、低白蛋白血症、食管或胃底静脉曲张,或持续黄疸)。
3)已知的或经研究者判断有临床意义的胆道异常(除外Gilbert综合征或无症状的胆结石及胆囊息肉)。
4)乙肝表面抗原[HBsAg]或乙肝核心抗体[HBcAb]检查呈阳性者,必须进行乙肝病毒脱氧核糖核苷酸(HBVDNA)滴度检测(超过1000拷贝[cps]/mL或200IU/mL不可入组),丙肝病毒(HCV)抗体阳性的受试者需进行丙肝病毒核糖核苷酸(HCVRNA)检测(超过测定法的检测下限不可入组)。
5)严重的肝功能不全:血清天冬氨酸转氨酶(AST)≥2倍正常值上限(ULN);血清丙氨酸转氨酶(ALT)≥2倍ULN;胆红素≥1.5倍ULN(当直接胆红素<35%,可允许间接胆红素≥1.5倍ULN)。
8.合并有心血管、脑血管和造血系统等严重原发性疾病。
9.人类免疫缺陷病毒(HIV)抗体阳性。
10.维生素D缺乏:定义为25-(OH)维生素D浓度小于20ng/mL。允许受试者补充维生素D后复查25-(OH)维生素D浓度。
11.血钙异常:当前低钙血症或高钙血症,定义为白蛋白校正的血清钙水平超出正常范围内。在血清钙筛查抽血前24h内受试者不得应用钙补充剂。
12.口腔、牙疾病:以往或当前有颌骨骨髓炎或颌骨坏死的证据;急性牙或颌骨疾病,需要口腔手术;计划行有创牙科手术;牙科或口腔手术未愈。
13.首次给药前2周,存在需要系统治疗的活动性或无法控制的感染。
14.1型糖尿病患者,血糖控制不佳或使用了胰岛素、胰高血糖素样肽-1(GLP-1)、噻唑烷二酮、SGLT2抑制剂等药物治疗的2型糖尿病患者。
15.正在参加其他医疗器械或药物(非表1中的药物,表1药物遵守表1禁用时限)临床试验,或自其他医疗器械或药物试验的末次访视尚未达到30天或5个半衰期(以时间长者为准,从签署知情同意书之日算起)。对于参加其他临床试验筛选失败,但尚未用药/给与临床器械治疗者,可以纳入本研究。
16.随机前接受过Denosumab及其生物类似药或Romosozumab给药。
17.接受过下列抗骨质疏松症治疗或影响骨代谢药物治疗者:
1)随机前5年内使用过氟化物、锶剂或静脉给药双膦酸盐药物;
2)随机前累计使用大于3年或12个月内使用过任何剂量的口服双膦酸盐药物;
3)随机前12个月内使用过甲状旁腺激素(PTH)或PTH衍生物,例如特立帕肽。
4)随机前3个月内使用过以下任一种药物:全身激素替代治疗、选择性雌激素受体调节剂、替勃龙、降钙素、骨化三醇、肝素、华法林、抗惊厥药(苯二氮卓类除外)、全身使用酮康唑、促同化激素类、睾酮、雄激素、促肾上腺皮质激、促性腺激素释放激素激动剂、西那卡塞、铝、锂、蛋白酶抑制剂、甲氨喋呤、口服或注射类糖皮质激素(每日用≥5mg/日强的松对等药物超过10天)。
18.有多于2处椎骨骨折史的受试者。
19.研究者判断的处于活动性骨折愈合期的受试者。
20.研究者判断骨折风险极高、必须立即使用活性药物治疗的受试者。
21.已知对研究方案所用治疗药物过敏,包括对地舒单抗有过敏史及对任何重组蛋白药物或HLX14或Prolia®中使用的任何成分有过敏史。
22.滥用药物(毒品)或酗酒者,最近12个月内有酗酒或滥用药物的证据。
23.各种身体或精神疾病、实验室检查异常,研究者认为会阻碍受试者完成研究或干扰研究结果的解释。或经研究者判断,受试者具有不适合参加本研究的其他因素。
研究者信息
主要研究者
姓名:辛力
学位:医学博士
职称:副主任医师
单位名称:徐州医科大学附属医院
各参加医院
| 序号 | 医院名称 | 主要研究着 | 地址 |
| 1 | 徐州医科大学附属医院 | 辛力 | 江苏省徐州市泉山区淮海西路99号 |
| 2 | 南京医科大学第二附属医院 | 鲁一兵 | 江苏省南京市鼓楼区姜家园121号 |
| 3 | 淮安市第一人民医院 | 毛莉 | 江苏省淮安市淮阴区北京西路6号 |
| 4 | 复旦大学附属华东医院 | 程群 | 上海市静安区延安西路221号 |
| 5 | 上海市浦东医院 | 易诚青 | 上海市浦东新区惠南镇拱为路2800号 |
| 6 | 瑞安市人民医院 | 杨虹 | 浙江省瑞安市万松路108号 |
| 7 | 浙江省人民医院 | 张骏 | 浙江省杭州市拱墅区上塘路158号 |
| 8 | 哈尔滨医科大学附属第四医院 | 成志锋 | 黑龙江省哈尔滨市南岗区颐园街37号 |
| 9 | 吉林大学第二医院 | 蔡寒青 | 吉林省长春市南关区自强街218号 |
| 10 | 北京积水潭医院 | 蒋协远 | 北京市西城区新街口东街31号 |
| 11 | 北京医院 | 薛庆云 | 北京市东城区东单大华路1号 |
| 12 | 河北医科大学第一医院 | 周慧敏 | 河北省石家庄市裕华区东岗路89号 |
| 13 | 天津市第一中心医院 | 夏群 | 天津市南开区复康路24号 |
| 14 | 内蒙古包钢医院 | 李子玲 | 内蒙古自治区包头市昆都仑区少先路20号 |
| 15 | 内蒙古自治区人民医院 | 徐永胜 | 内蒙古自治区呼和浩特市赛罕区昭乌达路20号 |
| 16 | 宁夏回族自治区人民医院 | 李红梅 | 宁夏回族自治区银川市金凤区正源北街301号 |
| 17 | 济宁医学院附属医院 | 班博 | 山东省济宁市任城区古槐路89号 |
| 18 | 山东大学齐鲁医院 | 刘新宇 | 山东省济南市历下区文化西路107号 |
| 19 | 潍坊市人民医院 | 王炳武 | 山东省潍坊市奎文区广文街151号 |
| 20 | 山西医科大学第二医院 | 朱亦堃 | 山西省太原市杏花岭区五一路382号 |
| 21 | 西安市红会医院 | 曾玉红 | 陕西省西安市碑林区南稍门友谊东路555号 |
| 22 | 河南省洛阳正骨医院 | 孔西建 | 河南省郑州市管城回族区永平路100号 |
| 23 | 安徽省立医院 | 陈超 | 安徽省合肥市庐阳区庐江路17号 |
| 24 | 安徽医科大学第一附属医院 | 章秋 | 安徽省合肥市蜀山区绩溪路218号 |
| 25 | 华中科技大学同济医院附属协和医院 | 沈霖 | 湖北省武汉市江汉区解放大道1277号 |
| 26 | 中南大学湘雅三医院 | 金萍 | 湖南省长沙市岳麓区桐梓坡路138号 |
| 27 | 四川大学华西医院 | 唐新 | 四川省成都市武侯区国学巷37号 |
| 28 | 遂宁市中心医院 | 张智 | 四川省遂宁市船山区德胜西路127号 |
| 29 | 重庆大学附属三峡医院 | 杨涛 | 重庆市万州区新城路165号 |
| 30 | 重庆医科大学附属第二医院 | 晏铮剑 | 重庆市渝中区临江路74号 |
| 31 | 南昌市第三医院 | 刘勇华 | 江西省南昌市西湖区象山南路2号 |
| 32 | 南昌洪都中医院 | 袁忠 | 江西省南昌市东湖区民德路264号 |
| 33 | 广州市第一人民医院 | 杨运发 | 广东省广州市越秀区盘福路1号 |
| 34 | 江西省人民医院 | 霍亚南 | 江西省南昌市东湖区爱国路152号 |
| 35 | 萍乡市人民医院 | 张雅薇 | 江西省萍乡市安源区武功山中大道8号 |
| 36 | 广州市第一人民医院 | 刘丰 | 广东省广州市越秀区盘福路1号 |
| 37 | 云南省第三人民医院 | 曹有良 | 云南省昆明市官渡区北京路292号 |
| 38 | 常州市第二人民医院 | 成金罗 | 江苏省常州市天宁区兴隆巷29号 |
| 39 | 北京市平谷区医院 | 李玉凤 | 北京市平谷区平谷镇新平北路59号 |
| 40 | 北京博爱医院 | 郑欣 | 北京市丰台区角门北路10号 |
| 41 | 河南科技大学第一附属医院 | 李利平 | 河南省洛阳市涧西区景华路24号 |
| 42 | 山东省立医院 | 徐进 | 山东省济南市槐荫区经五纬七路324号 |
| 43 | 山西医科大学第一医院 | 兰丽珍 | 山西省太原市迎泽区解放南路85号 |