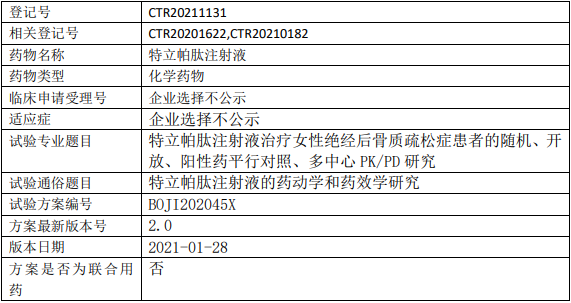
翰宇药业特立帕肽临床试验,特立帕肽注射液治疗女性绝经后骨质疏松症患者的I期临床试验
试验目的
以原研药物特立帕肽注射液(商品名:复泰奥/FORTEO)为阳性对照,分析皮下注射特立帕肽注射液药物代谢动力学特征,并与原研药物进行等效分析,并评价皮下注射特立帕肽注射液治疗女性绝经后骨质疏松症患者的有效性和安全性。
试验设计
试验分类:药代动力学/药效动力学试验
试验分期:I期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:55岁(最小年龄)至85岁(最大年龄)
性别:女
健康受试者:无
出入排标准
入选标准
1、自愿参加临床试验,并签署知情同意书
2、年龄55(含)-85(含)周岁的绝经后女性
3、体重≥40kg,30kg/m2≥体重指数≥18kg/m2
4、符合骨质疏松症诊断标准
5、被评估为骨折高危风险者,即符合下列标准之一者:
1.过去12个月内有骨折史;
2.在进行抗骨质疏松治疗期间出现骨折;
3.多发性骨折;
4.T-值<-3.0;
5.有跌倒高风险或有跌倒损伤史;
6.经FRAX(断裂风险评估工具)评估患者具有非常高的骨折可能(例如重大骨质疏松症骨折>30%,髋部骨折>4.5%)
排除标准
1、已知或怀疑对特立帕肽及其辅料、碳酸钙类药物、维生素D类药物有过敏史或严重不良反应者。
2、已知患有影响钙或骨代谢的疾病,如未得到有效控制的甲状旁腺功能亢进或甲状腺功能亢进、成骨不全、骨软化症、Paget’s骨病、高钙血症、低钙血症、活动性尿石症。
3、继发性骨质疏松症患者,如类风湿性关节炎、痛风、原发性骨肿瘤(如多发性骨髓瘤、骨肉瘤和软骨肉瘤等)、继发性骨肿瘤、血液系统肿瘤等疾病或药物所致骨质疏松症。
4、已接受过下列抗骨质疏松症治疗:
①筛选前接受口服双膦酸盐药物治疗累积使用≥3年者,或3个月<累积使用<3年,最后1次用药在筛选访视6个月内者;
②筛选前24个月内接受过静脉注射双膦酸盐药物治疗者;
③筛选前3个月内接受注射或滴鼻给予降钙素治疗者;
④筛选前3个月内接受口服、阴道、经皮或注射给予基于雌/孕激素的治疗药物(如雌激素、孕激素、SERMs制剂);
⑤筛选前6个月内接受过地舒单抗(或称地诺单抗、地诺塞麦、狄诺塞麦)治疗者;
⑥接受过任何PTH类药物治疗者(包括参加过同类产品临床试验);
⑦筛选前3个月内接受过维生素K类制剂、活化维生素D制剂(骨化三醇、α-骨化醇)治疗者。
5、有全身性皮质类固醇治疗史,定义为筛选前2年内累计超过10天的任何静脉、肌内或口服皮质类固醇治疗。关节腔内和硬膜外使用皮质类固醇均不排除。
6、由研究者确认的不明原因的血清碱性磷酸酶升高。
7、腹部皮肤存在影响局部注射给药的皮肤疾病(如皮肤红肿、发炎、破损或其它影响药物吸收的情况)。
8、合并有恶性肿瘤,或严重或长期致残的疾病(如脑卒中、帕金森病、多发性硬化症)而无法行动者。
9、合并有严重心脏病者,如心肌梗死、不稳定型心绞痛、NYHA心功能分级为Ⅲ-Ⅳ级的充血性心力衰竭、严重心律失常等。
10、合并严重肝肾疾病,或肝肾功能检查异常(ALT、AST≥正常上限2倍,Scr≥正常上限1.2倍)。
11、正在使用洋地黄类药物治疗者。
12、有可能导致吸收障碍的胃肠道疾病史,如口炎性腹泻、炎症性肠病等。
13、接受过主要器官或骨髓移植的患者。
14、接受过外照射或骨骼植入放射性治疗的患者。
15、血清抗-HIV、梅毒抗体、抗-HCV、HBsAg检查阳性者。
16、合并有神经、精神疾患而无法合作或不愿合作者,或有自杀倾向者。
17、怀疑或确有酒精、药物滥用或依赖倾向者,或酒精呼气试验结果大于0.0mg/100ml者,或药物滥用筛查(包括:吗啡、冰毒(甲基安非他明)、氯胺酮、摇头丸(二亚甲基双氧安非他明)、大麻(四氢大麻酚酸))阳性者。
18、入选前3个月内参加过其它临床试验者。
19、研究者认为不宜参与本试验的其它情况者。