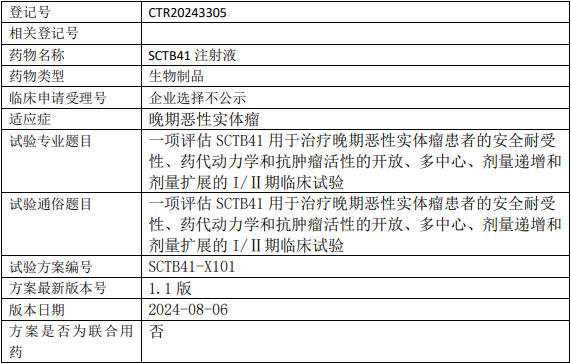
神州细胞SCTB41临床试验,评估SCTB41注射液用于治疗晚期恶性实体瘤安全耐受性、药代动力学和抗肿瘤活性的I/II期临床试验
试验目的
Ia期:主要评估SCTB41单药在晚期恶性实体瘤患者中的安全性和耐受性;
Ib期:确定SCTB41单药在晚期恶性实体瘤患者中的II期推荐剂量(RP2D)并评估初步抗肿瘤活性及安全性;
Ⅱ期:评估SCTB41单药在晚期恶性实体瘤(特定瘤种)患者中的初步疗效。
试验设计
试验分类:安全性和有效性
试验分期:其它 其他说明:I/Ⅱ期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿签署知情同意书。
2、年龄 ≥ 18周岁,性别不限。
3、预计生存期超过3个月。
4、ECOG评分≤1分。
5、参加Ia期剂量递增研究的受试者需满足:经组织学或细胞学确诊的晚期恶性实体瘤,经充分标准治疗失败。
6、参加Ib期、Ⅱ期研究的受试者需满足:经组织学或细胞学确诊的特定晚期恶性实体瘤,既往至少接受1-2种标准系统治疗方案治疗失败。
7、根据RECIST v1.1标准至少有1个可测量病灶。
8、具有充分的器官和骨髓功能。
排除标准
1、存在脑干、脑膜转移、脊髓转移或压迫,活动性中枢神经系统转移。
2、患有其他恶性肿瘤。
3、存在严重心脑血管疾病。
4、存在任何活动性自身免疫病或有自身免疫病病史且预期复发。
5、在入组前4周内接受过化疗、免疫治疗、生物制剂治疗等抗肿瘤治疗。
6、入组前2周内或预计研究期间需要使用免疫抑制药物。
7、具有重大凝血障碍或其他明显出血风险证据。
8、入组前4周内,不能控制的浆膜腔积液。
9、既往抗肿瘤免疫治疗过程中曾出现导致永久停药的免疫相关毒性。
10、已知对同类抗体大分子药物严重过敏。
11、活动性感染,HIV抗体阳性者,活动性乙肝或丙肝。
12、间质性肺病病史。
13、有器官移植史或干细胞移植史。
14、入组前4周内接种过活疫苗。
15、妊娠或哺乳期妇女。
16、当前已入组至其他研究器械或研究药物治疗中。
17、存在精神病史或研究者认为不适宜参加本研究的其他情况。