瀚科迈博HuA21临床试验,评价重组抗HER2人源化单克隆抗体HuA21注射液治疗HER2阳性晚期恶性实体肿瘤安全性、耐受性和药代动力学特征的I期临床试验
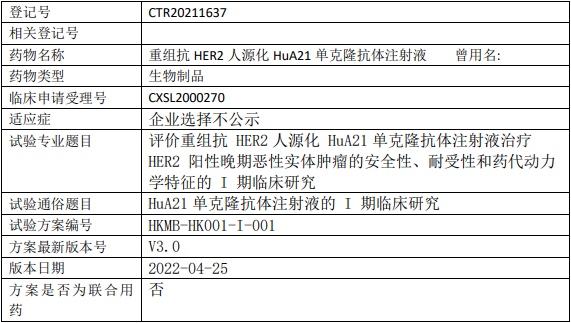
试验目的
1、评价HuA21治疗HER2阳性晚期恶性实体肿瘤患者中的安全性和耐受性,探索剂量限制性毒性(DLT)和最大耐受剂量(MTD);
2、初步观察HuA21联合曲妥珠单抗、化疗药治疗HER2阳性多种特定晚期恶性实体瘤患者的抗肿瘤疗效。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄:18-75岁(含18和75岁),男女不限。
2、经组织学或细胞学确诊的HER2阳性的晚期(不可接受手术或转移)实体瘤患者:
a)剂量递增阶段(PART1):既往接受过标准治疗后疾病进展或标准治疗不能耐受的恶性实体肿瘤患者;
b)联合给药治疗扩展阶段(PART2):
(1)曲妥珠单抗治疗失败的且未使用过卡培他滨治疗的HER2阳性晚期乳腺癌患者;
(2)转移性胃腺癌或胃食管交界腺癌患者:
①既往未接受曲妥珠单抗治疗;
②晚期复发/转移阶段使用曲妥珠单抗有效,但因其他原因停药者,可纳入本研究。
3、确认HER2阳性:免疫组化(IHC)3+或荧光原位杂交法(FISH)阳性;IHC(2+)时需要通过基因检测FISH进一步检测为阳性。
4、根据RECIST1.1标准患者具有至少1个可测量病灶,位于既往放疗照射野内或局部治疗后的可测量病灶如果证实发生进展,且该病灶不是唯一病灶的情况下,亦可选为靶病灶。
5、ECOG体力状况0或1分。
6、预期生存超过12周;
7、患者有足够的器官和骨髓功能,满足以下实验室检查表标准(以临床试验中心正常值为准):
●绝对中性粒细胞计数(ANC)≥1.5×109/L,血小板≥100×109/L,血红蛋白≥9g/dL;
●血清总胆红素≤1.5倍正常值上限(ULN),ALT、AST或ALP≤2.5倍ULN,有肝转移时血清总胆红素(TBIL)≤1.5倍ULN,ALT、AST或ALP≤5倍ULN;
●血清肌酐≤1.5倍ULN,或者肌酐清除率>50mL/min(根据Cockcroft-Gault公式计算);
●国际标准化比值(INR)或凝血酶原时间(PT)≤1.5×ULN,或活化部分凝血活酶原时间(APTT)≤1.5倍ULN(在未使用抗凝剂的情况下)。
8、育龄期女性在首次给药前7天内,血妊娠试验阴性、未处于妊娠期或哺乳期。有生育能力的男性或女性患者必须同意在研究期间和末次研究用药后6个月内使用有效的避孕方法,例如双重屏障式避孕方法,避孕套,口服或注射避孕药物,宫内节育器等。
9、对本研究已充分了解并自愿签署知情同意书。
排除标准
1、对研究药物或同类药物、曲妥珠单抗或其制剂辅料存在严重过敏反应,或过敏体质者。
2、研究治疗开始前4周内进行过手术或抗肿瘤治疗,包括化疗、放疗(为减轻疼痛对骨骼的姑息性放疗除外)、靶向治疗、生物治疗(如抗肿瘤疫苗)、免疫治疗,2周内进行过内分泌治疗或中药抗肿瘤治疗者(中药治疗是以抗肿瘤为目的或中药里有抗肿瘤成分或说明书有抗肿瘤适应症),或者预期在研究治疗期间需要接受大手术。
3、既往抗肿瘤治疗的毒性反应尚未恢复到CTCAE5.0版0或者1级水平(脱发除外)。
4、已知存在中枢神经系统转移和/或癌性脑膜炎(新发无症状脑转移(颅内病灶为孤立病灶且长径小于等于1cm)不需要放疗的受试者允许入组)。
5、合并有严重的急慢性疾病或并发症,如消化道出血,肠梗阻,肠麻痹,间质性肺炎,肺纤维化,肾功能衰竭,青光眼和控制不佳的糖尿病者。
6、入选前6个月内患有急性心肌梗死、不稳定心绞痛、卒中、或短暂性缺血性发作等疾病史,美国纽约心脏病学会(NYHA)分级为2级以上(含2级)的充血性心力衰竭,左室射血分数(LVEF)低于50%,高血压控制不佳。
7、已知患有合并慢性活动性乙型肝炎(HBV)、丙肝(HCV)和人类免疫缺陷病毒(HIV)疾病,或乙肝表面抗原(HBsAg)阳性受试者的HBVDNA超过正常值上限,或丙型肝炎病毒抗体(HCVAb)阳性受试者的HCVRNA阳性。
8、已知有原发性免疫缺陷病史,异体器官移植史和异体造血干细胞移植史。
9、正在参加其他临床研究或在入组研究前4周内(或其他研究药物的5个半衰期内)参加其他临床研究且接受过试验药物给药者。
10、入组前5年内患有其他恶性肿瘤,但经过充分治疗的皮肤基底细胞癌或鳞状上皮细胞癌、根治术后局部前列腺癌及乳腺导管原位癌、甲状腺乳头状癌除外。
11、有蒽环类药物治疗史,且累积剂量超过360mg/m2多柔比星等效剂量者。
12、经研究者判断,存在其他可能导致中途终止的因素者:如,其他的严重疾病(含精神疾病)需合并治疗,有严重的实验室检查异常,伴有家庭或社会等因素,可能会影响到受试者的安全或试验资料及样品的收集。
13、根据研究者的判断,由于其他原因不适合参加本研究的患者。