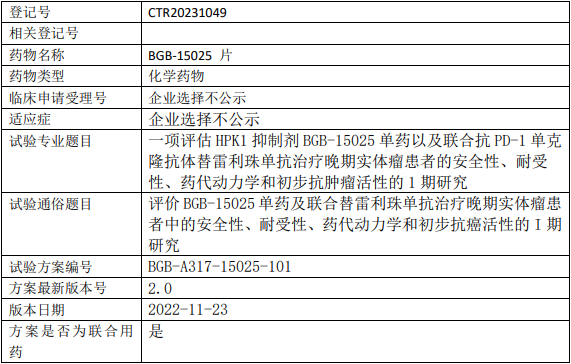
百济神州BGB-15025临床试验,评估HPK1抑制剂BGB-15025片单药以及联合抗PD-1单克隆抗体替雷利珠单抗治疗晚期实体瘤安全性、耐受性、药代动力学和初步抗肿瘤活性的I期临床试验
试验目的
主要目的
1、BGB-15025单药以及联合替雷利珠单抗治疗在晚期实体瘤患者中的安全性和耐受性;
2、确定BGB-15025 单药以及联合替雷利珠单抗治疗的最大耐受剂量(MTD)或最大给药剂量(MAD)和扩展期推荐剂量(RDFE)。
次要目的
1、评估BGB-15025 单药以及联合替雷利珠单抗治疗的初步抗肿瘤活性;
2、表征BGB-15025 单药以及联合替雷利珠单抗给药时BGB-15025及其代谢产物BGB-21958的药代动力学(PK)特征。
试验设计
试验分类:其他 其他说明:安全性与耐受性
试验分期:I期
设计类型:交叉设计
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限 (最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、Ia 期(剂量递增):患有经组织学或细胞学证实的晚期、转移性、不可切除的实体瘤,既往接受过标准全身治疗或治疗不可用、不耐受或被拒绝,且既往未接受靶向HPK1 的治疗的患者。
2、至少有1个RECIST 1.1版定义的可测量病灶,选择的靶病灶之前未接受过局部治疗,或者选择的靶病灶虽然既往接受过局部治疗,但随后出现RECIST 1.1版定义的进展。
3、患者必须能够提供确诊晚期或转移性肿瘤后获得的存档肿瘤组织样本(约17张新鲜未染色切片),首选最近一线治疗后获取的组织样本,如果没有存档组织,必须提供既往未接受过放疗的新鲜肿瘤样本。
4、ECOG体能状态评分≤ 1。
5、器官功能良好,表现为研究药物首次给药前具有以下实验室值:
●中性粒细胞绝对计数≥1.5×109/L;
●血小板计数≥75×109/L;
●血红蛋白≥90g/L;
●血清总胆红素≤1.5×ULN(Gilbert综合征患者必须<3×ULN);
●AST及丙氨酸氨基转移酶(ALT)≤2.5×ULN。
6、年龄≥18岁(或法定同意年龄),男女不限。
7、针对剂量扩展阶段:
●队列A:经组织学检查确认的局部晚期或复发性不适合根治性手术或放疗,或转移性鳞状或非鳞状NSCLC;
●队列B:经组织学检查确认的局部晚期不可切除或转移性G、GEJ腺癌;
●队列C:经组织学检查确认的局部晚期不可切除或转移性ESCC。
排除标准
1、有活动性软脑膜疾病或不受控且未经治疗的脑转移,转移结果不明确或确认脑转移的患者如果没有症状并且经放射学检查确定处于稳定状态,及在首次研究治疗给药之前至少4周无需皮质类固醇治疗,则可入组。
2、有活动性自身免疫性疾病或者有自身免疫性疾病史但可能复发的患者应排除,但以下情况除外:
a.控制良好的1 型糖尿病;
b.甲状腺功能减退症(如果仅用激素替代疗法便可以控制);
c.控制良好的乳糜泻,定义为严重程度仅限于轻度,采用无麸质饮食可以得到充 分控制;
d.无需全身治疗的皮肤病(例如白癜风、银屑病、脱发);
e.在没有外部触发因素的情况下不会再次发生的疾病。
3、在研究治疗首次给药之前2 年内有任何活动性恶性肿瘤,但本研究中正在研究的特定癌症以及已经治愈的局部复发性癌症(例如已经切除的基底细胞或鳞状细胞皮肤癌、浅表性膀胱癌、宫颈原位癌或乳腺原位癌)除外。
4、患有任何在研究治疗首次给药前14 天内需要用皮质类固醇全身治疗(剂量高于10mg/d 的泼尼松龙或同类药物等效剂量)或其他免疫抑制剂治疗的病症,但以下情况除外:
a.肾上腺素替代性类固醇(泼尼松龙≤10 mg/d或同类药物等效剂量);
b.全身吸收量极小的局部、眼用、关节内、鼻内和吸入性皮质类固醇;
c. 预防性地短期(≤7天)使用皮质类固醇(例如,对造影剂过敏)或用于治疗 非自身免疫病症(例如,由接触性过敏原引起的迟发型超敏反应)。
5、有间质性肺病、非感染性肺炎或控制不良的肺病史(包括但不限于肺纤维化、急性肺病等)(注:肺功能显著受损或基线时需要吸氧的患者必须在筛选时进行肺功能评估)。
6、无法控制的胸腔积液、心包积液或需要频繁引流或医学干预的腹水(在研究治疗首次给药前2周内出现需要额外干预且具有临床意义的复发)。
7、研究治疗首次给药之前1个月内出现具有临床意义的胃肠道出血(CTCAE≥2级)。
8、具有临床意义的食管/肠梗阻(CTCAE≥2级)。
9、针对剂量扩展阶段:
队列A:
a)已知可靶向治疗的突变(包括但不限于表皮生长因子受体(EGFR)基因突变、间变性淋巴瘤激酶(ALK)融合原癌基因、BRAFV600E(RET、MET和ROS1)突变且已有靶向治疗获得当地卫生当局批准并在当地可及。如果EGFR状态未知,患者应进行当地检测;
b) 既往接受过EGFR或ALK抑制剂治疗;
c)既往接受过抗PD-1、抗PD-L1、抗PD-L2、抗TIGIT、抗CTLA4或其他特异性靶向T细胞共刺激或检查点通路的抗体或药物治疗;
队列B:
a)鳞状细胞癌或未分化癌或其他组织学类型的G/GEJ癌症患者;
b)诊断为HER2阳性的G/GEJ腺癌(定义为IHC[免疫组化]3+或IHC2+和ISH[原为杂交]+),如果HER2状态未知,患者应进行当地检测;
c) 既往接受过抗PD-1、抗PD-L1、抗PD-L2、抗TIGIT、抗CTLA4或其他特异性靶向T细胞共刺激或检查点通路的抗体或药物治疗;
d) 在研究治疗开始前6个月内有胃肠穿孔和/或瘘或主动脉食管瘘病史,或肿瘤侵犯食管病灶邻近器官(如主动脉或呼吸道)且研究者评估发生瘘的风险增加;
队列C:
a)既往接受过抗PD-L1之外的免疫CPI治疗,包括但不限于抗CTLA4、抗TIGIT或其他特异性靶向T细胞共刺激或检查点通路的实验用药物;
b)在研究治疗前6个月内有胃肠穿孔和/或瘘或主动脉食管瘘病史,或肿瘤侵犯食管病灶邻近器官(如主动脉或呼吸道)且研究者评估发生瘘的风险增加。