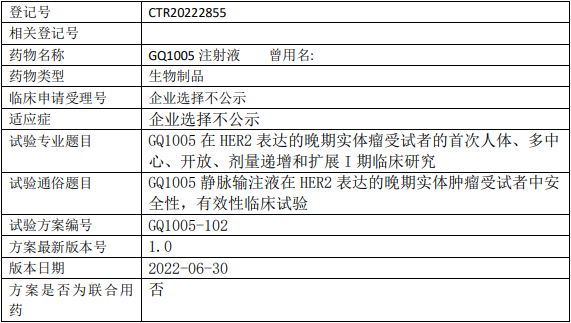
启德医药GQ1005临床试验,GQ1005注射液治疗HER2表达的晚期实体肿瘤安全性、有效性的I期临床试验
试验目的
第1部分(剂量递增)将评估GQ1005的安全性、耐受性和初步抗肿瘤活性,以确定MTD/RP2D。
第2部分(剂量扩展)将进一步评估GQ1005在MTD/RP2D时在选定的HER2表达的晚期实体瘤受试者中的安全性和疗效。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
第1部分剂量递增和第2部分剂量扩展的通用入选标准如下:
1、签署知情同意书(informed consent form,ICF)并能够遵守研究方案;
2、签署ICF当天年龄≥18岁的男性和女性受试者;
3、预期寿命>3个月;
4、ECOG体能状态评分为0或1;
5、在研究药物首次给药前28天内,通过ECHO或MUGA扫描显示LVEF≥ 50%;
6、组织学或细胞学确诊的恶性肿瘤,且根据RECIST v1.1评估存在至少1个可测量病灶;
7、器官功能良好,在筛选期和研究药物首次给药前7天内完成实验室检查结果合格:
●血小板计数≥100,000/mm3
●血红蛋白≥8g/dL
●中性粒细胞绝对计数(absoluteneutrophilcount, ANC) ≥1500/mm3
●血清肌酐(creatinine,CREA)≤1.5×ULN,或估计的CREA清除率≥60mL/min(Cockcroft-Gault公式)ALT和AST≤3×ULN(如果存在肝转移,则≤5×ULN)
●总胆红素≤1.5×ULN或≤2×ULN,针对Gilbert综合征受试者
●凝血酶原时间和活化部分促凝血酶原激酶时间≤1.5×ULN
8、首次治疗前有充分的洗脱期:
治疗洗脱期
●大手术≥4周
●放射治疗≥4周(如果放射治疗为不涉及腹部的姑果息性立体定向放射治疗,则≥2周)
●放射性粒子治疗≥3个月
●核素治疗≥3个月
●自体移植≥3个月
●激素治疗≥2周或根据研究者的判断(乳腺癌受试者)
●化疗或靶向治疗(包括抗体药物治疗)≥2周(基于5-氟尿嘧啶(5-FU)的药物、亚叶酸制剂和/或每周一次紫杉醇治疗);≥2周(或5个半衰期,以较短者为准)(酪氨酸激酶抑制剂);≥4周(HER2靶向生物治疗);≥6周(亚硝基脲或丝裂霉素C);≥3周(任何其他化疗/靶向治疗);免疫治疗≥4周
●任何试验用药物或治疗≥4周
仅针对于第1部分剂量递增阶段的入选标准:
9、标准治疗失败、或不耐受、或无标准治疗、有病理学记录证实的、HER2免疫组化(immunohistochemistry,IHC)阳性表达(包括1+或2+或3+)的晚期/不可切除或转移性实体瘤受试者。如果仅原位杂交*(in situ hybridization,ISH)、二代测序(next-generation sequencing,NGS)报告可用,请联系医学监查员;
仅针对于第2部分剂量扩展阶段的入选标准:
10.受试者需提供最近6个月内活检获取肿瘤组织的HER2IHC结果和/或NGS、ISH的结果,或同意再次活检提交新鲜肿瘤活检样本用于评估HER2状态。
仅针对于第2a部分的入选标准:
11.标准治疗失败、或不耐受、或无标准治疗、有病理学记录证实的、HER2过表达的(IHC3+或IHC2+/SH*+)晚期/不可切除或转移性乳腺癌。
仅针对于第2b部分的入选标准:
12.标准治疗失败、或不耐受、或无标准治疗、有病理学记录证实的、HER2低表达的晚期、或不可切除的、或转移性的乳腺癌,或胃或胃食管交界处腺癌(IHC2+且ISH*-或ISH未知,或IHC1+)。
仅针对于第2c部分的入选标准:
13.标准治疗失败、或不耐受、或无标准治疗、有病理学记录证实的、HER2IHC阳性表达(包括1+或2+或3+)的晚期/不可切除或转移性子宫内膜癌,如果仅ISH*、NGS报告可用,请联系医学监查员。
仅针对于第2d部分的入选标准:
13.标准治疗失败、或不耐受、或无标准治疗、有病理学记录证实的、HER2表达的晚期/不可切除或转移性实体瘤,首选HER2过表达(IHC3+或IHC2+/ISH*+),或HER2外显子19或20突变的非小细胞肺癌;其他优选肿瘤类型包括HER2过表达(IHC3+或IHC2+/ISH*+)的尿路上皮癌、胆道癌、胃、胃食管交界处腺癌;乳腺癌、子宫内膜癌除外。
注:*ISH+:荧光原位杂交(fluorescenceinsituh ybridization,FISH)或双色原位杂交(dualcolorinsituhybridization, DISH)
排除标准
1、脑转移;
2、需要在研究药物首次给药前7天内使用皮质类固醇(>10 mg/天泼尼松相当剂量)进行全身治疗,或在研究药物首次给药前14天内使用任何其他免疫抑制药物;
3、心血管功能障碍或有临床意义的心脏疾病,包括但不限于: 有症状的充血性心力衰竭(congestive heart failure,CHF)(纽约心脏病协会II级至IV级)或需要治疗的严重心律失常病史; 有心肌梗死或者肌钙蛋白水平与心肌梗死一致(根据美国心脏病学会指南定义)的病史,以及在研究药物首次给药前6个月内或有不稳定型心绞痛; 筛选时除右束支传导阻滞外,QTcF延长>460毫秒(ms)(男性)和>470 ms(女性);
4、有临床意义的肺部疾病(如间质性肺炎、肺炎、肺纤维化和严重放射性肺炎)病史,或在筛选期影像学检查时或需要补充氧时怀疑有这些疾病的试者;
5、已知对制剂中的原料药或非活性成分过敏;
6、研究者判定为有临床意义的角膜疾病2级或以上;
7、既往抗肿瘤治疗的毒性尚未缓解,定义为毒性(脱发除外)尚未缓解至≤1级或基线水平,对于有慢性2级毒性的受试者是否有资格参加研究,需由研究者判断;
8、蒽环类药物累积剂量>360 mg/m2;
9、存在需要静脉输注抗生素、抗病毒药或抗真菌药治疗的活动性感染;
10、已知存在人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染;
11、活动性丙型肝炎感染(例如,可检测到丙型肝炎病毒[hepatitis C virus,HCV]抗体),或活动性乙型肝炎感染(hepatitis B virus,HBV)(如乙型肝炎表面抗原[hepatitis B surface antigen,HBsAg]阳性);需除外隐匿性或既往乙型肝炎感染的受试者(定义为乙型肝炎核心抗体阳性和HBsAg阴性),且这些受试者需要同意每月进行一次脱氧核糖核酸(deoxyribonucleic acid,DNA)检测并根据指征接受适当的抗病毒治疗;
12、在研究药物首次给药前30天内,经认证的核酸检测显示严重急性重症呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)阳性;
13、研究药物首次给药前30天内接种活疫苗;
14、既往或当前存在任何伴随疾病、治疗或实验室检查异常的证据,研究者认为可能混淆试验结果或干扰受试者参与和依从性;
15、接受过包含有拓扑异构酶I抑制剂依喜替康衍生物的抗体偶联药物治疗;
16、哺乳期妇女或首次治疗前 7 天内进行妊娠试验证实怀孕的妇女;
17、在研究期间和研究药物末次给药后至少7个月内,不愿意避孕;
18、受试者在过去3年内患有多种原发性恶性肿瘤,充分切除的非黑色素瘤皮肤癌、已治愈的原位疾病、已治愈的对侧乳腺癌除外;