信达生物IBI112临床试验,评价IL-23p19单抗IBI112治疗中重度斑块状银屑病有效性和安全性Ⅲ期临床试验
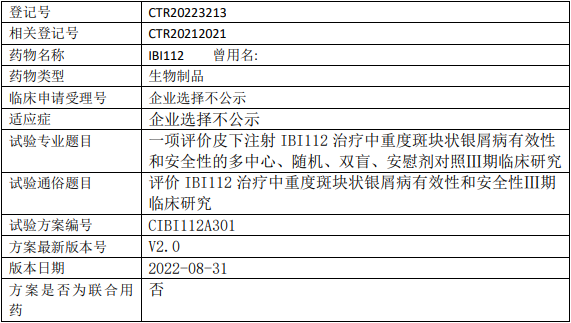
试验目的
主要目的
---评价与安慰剂相比皮下注射IBI112治疗中重度斑块状银屑病的有效性。
次要目的
---评价IBI112治疗中重度斑块状银屑病的安全性;
---评价IBI112长期治疗中重度斑块状银屑病的有效性;
---评价IBI112在中重度斑块状银屑病患者的群体药代动力学特征;
---评价IBI112在中重度斑块状银屑病患者的免疫原性;
---评价IBI112治疗中重度斑块状银屑病对患者健康相关生活质量影响;
---评价IBI112治疗基线存在头皮银屑病患者对头皮银屑病的有效性;
---评价IBI112治疗基线存在甲银屑病患者对甲损害的有效性;
---评价IBI112治疗基线存在掌跖银屑病患者对掌跖银屑病的有效性;
---评价IBI112治疗基线存在会阴区银屑病患者对会阴区银屑病的有效性;
---探讨IBI112对银屑病关节炎(PsA)患者基线PsA活动度评分的有效性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、18岁≤年龄≤75岁的男性或女性
2、诊断为斑块状银屑病≥6个月,合并或不合并银屑病关节炎
3、在筛选和基线时,PGA≥3,PASI≥12,且累及BSA≥10%
4、受试者适合银屑病的光疗和/或系统治疗
5、对试验目的充分了解,对试验药物的药理作用及可能发生的不良反应基本了解;按赫尔辛基宣言精神,自愿签署知情同意书
排除标准
1、诊断患有非斑块状银屑病之外的其他类型银屑病(点滴状银屑病、脓疱型银屑病或红皮病型银屑病)
2、诊断为药物诱导性银屑病
3、既往使用过IBI112者,或IL-23靶点治疗
4、首次使用研究药物前2周内接受了可能影响银屑病评价的局部治疗药物;
首次使用研究药物前4周内接受了可能影响银屑病评价的系统药物治疗;
首次使用研究药物前3个月内(或在药物5个半衰期内)接受了肿瘤坏死因子-α(TNF-α)拮抗剂;
首次使用研究药物前6个月内(或在药物5个半衰期内)接受了IL-17靶点的治疗;
首次用药前12个月内使用过Natalizumab、或B细胞或T细胞调节剂;
5、首次用药前1个月内使用过银屑病光疗,和/或不愿意在研究期间避免持续日光暴晒和避免其他紫外线光源
6、有证据表明受试者有严重的、进行性的、未控制的(包括但不限于)心血管疾病、神经肌肉疾病、血液疾病、呼吸疾病、肝脏或消化疾病、泌尿疾病、神经或精神疾病
7、筛选前6个月内有过机会性感染
8、已知有复发或慢性感染病史,曾患有慢性或反复发作的感染;有严重感染病史(例如脓毒血症、肺炎、肾盂肾炎),或在筛选前2个月内因感染住院或接受静脉抗生素治疗
9、有恶性肿瘤或恶性肿瘤病史(已成功切除并且5年内无复发转移证据的皮肤鳞状细胞癌,基底细胞癌或局部宫颈原位癌除外)
10、患有或曾患有淋巴组织增生疾病,或筛选前5年内存在提示淋巴增生疾病的症状或体征,例如淋巴结和/或脾大
11、已知有活动性结核病史或临床表现疑似为结核病患者(包括但不限于肺结核、淋巴结核、结核性胸膜炎等)
12、首次使用研究药物前12个月内接种过卡介苗,或计划在研究期间或末次研究治疗后的12个月内接种卡介苗
13、首次使用研究药物前3个月内接种活疫苗或细菌疫苗,或计划在研究期间或末次研究治疗后的3个月内接种活疫苗或细菌疫苗
14、首次使用研究药物前6个月内接受过试验性生物制剂治疗,或30天内接受过任何试验治疗,或在5个半衰期内的研究药物,或正在参加一项临床研究
15、筛选期和基线期血常规和血生化检查结果满足下述情况:
血红蛋白、红细胞、白细胞、中性粒细胞、血小板任意指标<正常下限,且经研究者判断异常有临床意义;
丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)任意指标>2倍正常上限;
肌酐(Creatinine,Cr)>正常值上限;
如复查后达到方案要求的范围,亦可入组
16、筛选时病毒检测结果,符合下述任意一条:
(1)人类免疫缺陷病毒(HIV)抗体阳性;
(2)无成功治疗史的丙型肝炎病毒(HCV)抗体阳性;
(3)乙肝病毒(HBV)筛查:乙肝表面抗原(HBsAg)、乙肝表面抗体(HBsAb)、乙肝核心抗体(HBcAb),以上三个指标的检查结果若:HBsAg阳性;或HBsAg阴性时,若仅HBcAb阳性,需检测HBVDNA且检查结果呈阳性;
(4)梅毒特异性抗体阳性(若经过正规梅毒治疗梅毒非特异性抗体滴度转阴者除外)。
17、筛选时具有以下有临床意义的12导联心电图(ECGs)异常:QTcF>450ms、PR间期缩短或延迟、Ⅱ度或Ⅲ度房室传导阻滞、预激综合征,长QT综合征;或需要治疗的严重心律失常
18、既往出现过严重药物、食物过敏反应者,和/或对试验药物或者其中成分过敏者
19、筛选前12个月内有酒精及药物滥用史
20、女性受试者在妊娠、哺乳期,或孕龄女性在筛选和给药前妊娠检查阳性
21、在研究期间以及研究药物给药后6个月内有生育计划,或不愿在试验期间采取医生认为适当的避孕措施者
22、研究者认为由于各种原因不适合参加本临床试验者