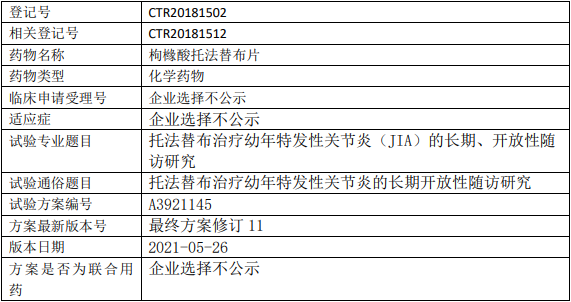
辉瑞制药托法替布临床试验,枸橼酸托法替布片治疗疗幼年特发性关节炎(JIA)的长期、开放性随访III期临床试验
试验目的
主要目的
确定托法替布治疗JIA的长期安全性和耐受性
次要目的
评估托法替布治疗JIA的疗效持续性
探索性目的
为在长期开放性研究背景中评价稳定剂量的托法替布在小儿受试者中的药代动力学、评价在小儿人群中随体重增加而出现的PK参数改变,并探索在该小儿人群长期暴露于托法替布后托法替布与疗效和安全性的暴露-反应关系
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:2岁(最小年龄)至无岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1.年龄处在2到<18岁范围内、符合资格/指标研究的入选标准,且经研究者确定有JIA疾病活动的充分证据,表明有必要将托法替布用作DMARD的小儿受试者。在参加资格/指标研究期间或之后达到18岁的受试者将有资格参加本研究。
2.受试者已在要求的研究药物首次给药前时间内停止禁用的伴随用药,且仅按照方案允许的剂量和频率使用伴随用药。
3.研究者认为性活跃且可能与伴侣一起面临妊娠风险的具有生育能力的男性受试者和女性受试者在整个研究期间以及研究药物末次给药后至少28天内必须使用本方案中概述的高效避孕方法。
4.受试者之前必须已完成治疗JIA的托法替布资格研究。在资格研究中因托法替布相关严重不良事件以外的原因而需要提前中止治疗的受试者可参加本研究
5.对于接受甲氨蝶呤(MTX)治疗的受试者,MTX可通过经口或注射给药途径给药,剂量不得超过25mg/周或20mg/m2/周(以较低者为准)。使用甲氨蝶呤的受试者必须依照当地标准使用叶酸或亚叶酸。
6.对于正在使用口服糖皮质激素的受试者,糖皮质激素可按最大剂量0.20mg/kg/天或10mg/天泼尼松或等效药物(以较低者为准)给药(在研究药物首次给药前4周及整个研究期间不允许进行肌内和静脉糖皮质激素给药)。对于来自全身型JIA研究A3921165的受试者,可在获得辉瑞医学监查员同意的情况下继续或开始使用较高的泼尼松等效剂量(剂量必须为≤1.0mg/kg/天,最高达30mg/天口服泼尼松[或等效药物])
7.对于正在接受来氟米特治疗的受试者,来氟米特可按照以下给药方案给药:每隔一天10mg(体重小于20kg的受试者);每天10mg(体重为20至40kg的受试者);每天20mg(体重超过40kg的受试者);或依照当地标准给药。
8.对于正在接受柳氮磺吡啶、氯喹或羟氯喹治疗的受试者,可依照当地标准给予这些药物
9.对于正在接受柳氮磺吡啶、氯喹或羟氯喹治疗的受试者,可依照当地标准给予这些药物
10.愿意并且能够遵从所有的访视安排、治疗计划、实验室检查和其他研究程序的受试者
11.研究者基于当前可用的治疗和对这些治疗的既往反应情况认为在临床上适合接受托法替布治疗的受试者
12.所有以下证据证明不存在活动性结核病(TB)或未得到充分治疗的结核病(TB)感染(活动性或潜伏性):
a.筛选前3个月内QuantiFERON-TBGold或GoldPlusIn-Tube检查4阴性。仅在中心实验室无法执行该检测或无法确定结果为阴性或阳性可使用硬结<5mm的纯化蛋白衍生物(PPD)检测阴性结果替代QuantiFERONTBGold或GoldPlusInTube检测。
b.建议在筛选前3个月内进行胸片检查,且应依照当地护理标准或国家特定指南执行该检查,检查结果应显示没有发生提示活动性结核病(TB)感染的改变。
c.没有未经治疗或未经充分治疗的潜伏性或活动性TB感染病史。若受试者既往曾接受潜伏性(在原发性多重耐药性TB感染发生率<5%的地区异烟肼给药9个月,或可接受的替代方案)或活动性(可接受的多药物方案)TB感染的适当疗程,则无需进行PPD检测和QuantiFERON-Gold或GoldPlus检测。若在筛选前3个月内未进行胸片检查,则应进行该检查。仅在胸片为活动性结核病感染阴性时,受试者才有资格参加研究。仅在确认多药物耐受性TB感染的当前发生率(<5%)和适当治疗方案的文件记录的情况下,目前正在接受潜伏性TB感染治疗的受试者才能入组研究。
排除标准
1.血液恶病质,包括:
a.Hgb<10g/dL或Hct<33%。
b.WBC<3.0x109/L。
c.中性粒细胞计数<1.2x109/L。
d.血小板计数<100x109/L。
e.淋巴细胞计数<0.75x109/L
2.筛选访视时采用BedsideSchwartz公式计算的肾小球滤过率估计值[GFR]为<40mL/min/1.73m2
3.天冬氨酸转氨酶(AST)或丙氨酸氨基转移酶(ALT)是正常值上限的1.5倍,或任何其他具有临床意义的实验室异常
4.具有持续性寡关节炎以及未分化性JIA
5.现有未得到控制且具有临床意义的肾脏、肝脏、血液学、胃肠道、内分泌、肺、心脏或神经系统疾病,或最近近期这些疾病病史
6.舍格伦综合征以外的任何其他风湿性自身免疫性疾病
7.淋巴增生性障碍史或现有提示该等疾病的症状(例如EpsteinBarr病毒(EBV)相关淋巴增生性障碍、淋巴瘤史、白血病史)或提示现有淋巴疾病的体征和症状
8.感染:
a.慢性感染。
b.在研究药物首次给药前3个月内需要住院或注射抗感染治疗或研究者判定为机会性感染的任何感染。
c.在基线访视2周内接受治疗的感染。(不包括仅接受过外用药物治疗的受受试者)。
d.已知感染人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)的受试者。
e.人工关节感染史(人工关节仍在原位)
9.复发性(发作超过一次)带状疱疹或单次发作的播散性带状疱疹或单次发作的播散性(同时有口腔和生殖器病灶,或广泛分布的病灶,而非仅有口腔或生殖器病灶)单纯疱疹病史
10.正在使用强效和中效细胞色素P4503A4(CYP3A4)抑制剂的受试者
11.正在使用强效或中效CYP3A4诱导剂的受试者
12.在研究药物首次给药前4周或5个半衰期(以较长者为准)内参与研究用化合物研究(不包括托法替布资格/指标研究)。受试者不得在参加本研究期间参加关于其他研究用化合物的研究。需与辉瑞医学监察员讨论研究生物制剂的暴露
13.任何采用非B细胞特异性淋巴细胞消耗剂/疗法(例如阿仑珠单抗[CAMPATH?]、烷化剂[例如环磷酰胺或苯丁酸氮芥]、全淋巴照射等)进行的既往治疗。已经接受利妥昔单抗或其他选择性B淋巴细胞消耗剂(包括试验制剂)的受试者可以参加研究,前提是他们在研究基线前未接受上述治疗至少1年,并且FACS分析确定的CD19/20+计数正常
14.妊娠或正在哺乳的女性应被排除
15.研究药物首次给药前4周内曾接受肌内或静脉糖皮质激素给药(根据入选标准,允许接受口服糖皮质激素)
16.研究药物首次给药前6周内已接受活或减毒疫苗接种的受试者。所有研究参与者都应接受最新的标准接种(由各国家的卫生部界定)。(避免与可能已接种的人发生家庭接触的进一步信息参见生活方式指南)
17.在研究药物首次给药前7天或5个半衰期内(以较长者为准)使用禁用的处方药、非处方药或膳食补充剂
18.研究药物首次给药前至少4周必须停用草药补充剂。
19.有一级亲属患遗传性免疫缺陷病的受试者;IgA缺陷无需除外
20.存在恶性肿瘤或其病史,不包括经过充分治疗或已切除的非转移性皮肤基底细胞或鳞状细胞癌,或原位宫颈癌
21.最近(研究药物首次给药前28天内)曾经历严重创伤或接受大手术
22.不愿或无法遵从本方案中所述的生活方式指南
23.可能增加与研究参与或研究药使用有关的风险,或者可能干扰研究结果判读和(根据研究者判断)可能使受试者不适合参加本研究的其他严重的急性或慢性医学或精神疾病或者实验室检验异常
24.属于研究中心职员、受研究者监督的研究中心职员或直接参与研究实施的辉瑞员工的子女或亲属的受试者
25.既往有过另一种JAK抑制剂(例如,巴瑞替尼)治疗失败
26.存在任何与静脉血栓栓塞可能相关的风险因素或临床特征,经研究者判断可能不适合入组本研究。这些与静脉血栓相关的风险因素,可能会增加与参与临床研究或研究用药给药相关的风险,或可能会干扰研究结果解读。
27.对乳糖或CP-690,550(托法替布)或研究用药品的任何其他辅料有过敏、不耐受或超敏反应史。这包括患有罕见遗传性半乳糖不耐受症、原发性乳糖酶缺乏症或葡萄糖-半乳糖吸收不良症的受试者。对于患有获得性乳糖不耐症的潜在受试者,研究者应考虑,其状况是否足以妨碍受试者参与研究。由于本品的口服液不包含乳糖,因此患有遗传性或获得性乳糖不耐受的受试者可应研究者要求接受托法替布口服液治疗,而非接受片剂治疗。
研究者信息
主要研究者
姓名:李彩凤
学位:医学博士
职称:主任医师
单位名称:首都医科大学附属北京儿童医院
国内参加医院
| 序号 | 医院名称 | 主要研究者 | 医院地址 |
| 1 | 首都医科大学附属北京儿童医院 | 李彩凤 | 北京市西城区南礼士路56号 |
| 2 | 首都儿科研究所附属儿童医院 | 赖建铭 | 北京市朝阳区雅宝路2号 |
| 3 | 复旦大学附属儿科医院 | 孙利 | 上海市闵行区万源路399号 |
| 4 | 重庆医科大学附属儿童医院 | 唐雪梅 | 重庆市渝中区中山二路136号 |
| 5 | 苏州大学附属儿童医院 | 封其华 | 苏州市苏州工业园区钟南街92号 |
| 6 | 西安市儿童医院 | 李小青 | 陕西省西安市莲湖区西举院巷69号 |
| 7 | 浙江大学医学院附属儿童医院 | 卢美萍 | 浙江省杭州市拱墅区竹竿巷57号 |